Étude AMOHI (2019-2024, Viet Nam)
Étude AMOHI (2019-2024, Viet Nam)
ÉTUDE AMOHI (2019-2024, VIET NAM)
Fin du projet AMOHI : L’IMEA vous informe que, à la suite des décisions prises par l’administration TRUMP, nous sommes contraints de mettre fin abruptement au projet AMOHI, financé par le National Institute of Health (NIH/NIDA) des Etats-Unis d’Amérique. Ce projet, mené au Vietnam depuis 2020, en collaboration avec le VN CDC de Ho Chi Minh City, le WISTAR Institute et l’Université de Pennsylvanie, les instituts PASTEUR de HCMC et Paris, l’association BIZIA de Bayonne, visait à améliorer l’accès des usagers de drogues infectés par le VIH aux traitements de substitution, d’une part, et à documenter les effets de ces traitements sur leur état immunologique et inflammatoire, d’autre part. Nous regrettons cette décision, qui prive ces patients d’opportunités thérapeutiques et qui ralentit les progrès de la recherche sur le VIH. ➡️ Ici
Titre : Recherche Clinique sur les traitements de substitution aux opiacés chez les patients VIH au Viet Nam
Partenaires : Vietnam Ministry of Health, Vietnam Administration of HIV/AIDS Control, Provincial AIDS Committee, University of Pennsylvania, IMEA, Pasteur Institute of Vietnam, Alkermes (industry partner), and The Wistar Institute.
Ce projet est financé par le NIDA (US National Institute on Drug Abuse) et dirigé par le WISTAR Institute, USA. L’IMEA est l’interface entre WISTAR, l’Université de Pennsylvanie, l’Institut Pasteur Paris / HCMC, l’association BIZIA (addictologues Biarritz) et les autorités vietnamiennes. L’IMEA (via l’association locale HAA, déjà impliquée dans le projet antérieur avec Expertise France) coordonnera le recrutement du personnel et l’implantation du projet dans les différents sites du Vietnam. Enfin l’IMEA reçoit la partie du budget dévolue au suivi des patients et à la gestion de l’équipe au Vietnam.
Objectif primaire
-
Comparer la concentration plasmatique de sCD14 chez les personnes atteintes de troubles liés à la consommation d’opiacés séropositives qui reçoivent un cART et de la méthadone, du buprénorphine/naloxone ou du XR-naltrexone sur une période de 48 mois.
Objectif secondaire
- 1) Évaluer le changement des marqueurs de l’activation immunitaire cellulaire et de la sénescence, de l’inflammation systémique et de la translocation bactérienne.
2) Évaluer l’efficacité du traitement administré pour a) réduire/supprimer le comportement d’injection d’opiacés et promouvoir le respect du calendrier de traitement et b) supprimer la réplication du VIH.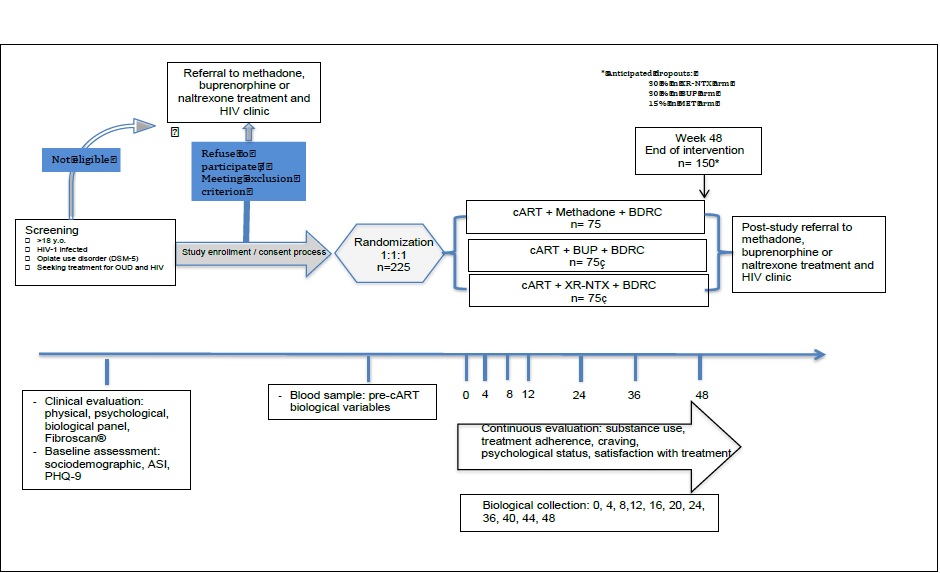
Méthode
Essai randomisé de 3 bras de 75 patients sur 60 mois.
Traitement (12 mois)
Méthadone orale, dose journalière, buprenorphine sublinguale, dose journalière puis 3 fois par semaine après stabilisation, naltrexone retard (Vivitrol®), injection une fois par mois. Surveillance de la fonction hépatique, notification des effets indésirables graves incluant les hospitalisations et les overdoses. L’étude sera suivie par les investigateurs principaux et les coinvestigateurs, l’Institutional Review Board de l’University of Pennsylvania, l’Institutional Review Board de Ho Chi Minh City HIV/AIDS center, ainsi que par les comités de réglementation de l’Université de Pennsylvanie (c.-à-d., IRB, OHR) et Center for Studies of Addiction Data Safety Monitoring Board (Penn DSMB). Au cours de l’étude, la surveillance de la pharmacovigilance et de la qualité des données sera effectuée de façon continue par les investigateurs principaux et le personnel de l’étude. Le Dr. Charles O’Brien (Center for Studies of Addiction, University of Pennsylvania) servira de moniteur médical pour l’étude.
Analyse
Le principal résultat d’intérêt est le changement de sCD14 sur 48 semaines sous traitemant ARV. Ce marqueur sera évalué sur sept points (baseline, semaines 4, 8, 12, 24, 36 et 48). Les analyses primaires pour ces données longitudinales utiliseront le modèle de régression de modèle mixte (MER) avec une probabilité maximale restreinte.


 Projets
Projets